“基因编辑技术”发展史
北京时间10月7日傍晚,瑞典皇家科学院宣布,2020年 诺贝尔化学奖授予两名女性科学家伊曼努埃尔·夏庞提尔(法)和珍妮佛·A·道纳(美),表彰她们“研发出一种基因组编辑方法”,即基因修饰方法CRISPR-Cas9。

(图说:夏庞提尔(左)和道纳。)
人们第一次发现CRISPR序列是在1987年,但第一次证明CRISPR-Cas9可以进行基因编辑,是道纳和夏庞提尔2012年在《科学》杂志上发表的第一篇研究论文。该论文中,两位女科学家带领的团队纯化了Cas9蛋白,首次在体外证明使用Cas9的CRISPR系统可以切割任意DNA链,指出CRISPR在活细胞中修改基因的能力。
科学家通过CRISPR可以高效、精确地改变、编辑或替换植物、动物甚至是人类身上的基因,经过改造的CRISPR技术被广泛地应用于农业和生物医药领域。由于简单、廉价和高效,CRISPR已经成为全球最为流行的基因编辑技术,被称为编辑基因的“魔剪”。
值得一提的是,最早证明CRISPR-Cas9可以编辑哺乳动物细胞基因的还有华人科学家、麻省理工学院教授、博德研究所资深研究员 张锋(Feng Zhang)和哈佛大学医学院教授乔治·彻奇(George Church)。两人此次无缘诺贝尔化学奖。但有科学家指出,与夏庞提尔和道纳的纯生化工作不同,张峰和彻奇两人的工作属于医学应用领域,在活体细胞中成功应用了CRISPR。

(图说:美国加州大学伯克利分校教授珍妮佛·A·道纳。图/AP)
2020年诺贝尔化学奖授予了埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)和詹妮弗·杜德纳 ( Jennifer Anne Doudna),获奖原因是开发了一种基因编辑的方法。
由于CRISPR在农业、生物医药和人类健康方面有极大的应用潜力,该技术早已得到众多奖项的认可,相关研究者也获得了大量荣誉。上一次这个名字进入大众视野,还是2018年11月的“基因编辑婴儿”。
基因编辑技术是什么?
是谁发明了这个相当于金矿的技术,又是谁让它熠熠生光?为什么中间出现了利益之争?卡彭蒂耶、杜德纳和华人科学家张峰,有过怎样的较量?
这些问题,将在本文一一解答。
如果盘点一下生命科学最近五年的大新闻,有一个词是无论如何也绕不过去的,那就是“基因编辑”。
离我很远,不明觉厉,偏偏又经常听说——这也许是一般人对基因编辑的几个印象。抛开媒体的种种称赞反思深刻批判不谈,咱今天就事论事地来讲讲,这基因编辑究竟是个什么东东,又能带给我们些什么西西?
基因好好的,为什么要被编辑?
如果你想了解汽车某个零件的功能,你会怎么做?最简单粗暴的办法就是把这个零件拆了,改了或是多装几个,看看汽车会出现什么变化。
研究基因的过程差不多也是这回事:将生物的基因序列做某种改造,看看生物会因此出现什么变化,从而了解那个基因可能的功能。把基因拆了、改了之类的操作,就可以叫做“基因编辑”。
不过,想拆螺母只要找个扳手,而编辑基因可就艰难多了。基因是潜藏在细长DNA链中的一段段序列。对于包括人类在内的多细胞生物来说,DNA被细胞层层叠叠的膜结构保护着,还有非常严谨的DNA修复机制应变。可以想象,细胞当中的DNA犹如一个身处于城堡之中的“小公举”,身边还有一大堆仆从侍卫保护,想对它做什么手脚,并不简单。
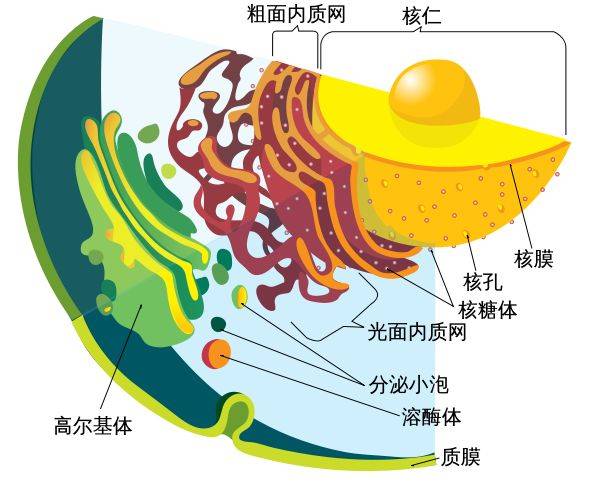 动物细胞的DNA被层层叠叠的膜结构保护着。图片来源:Mariana Ruiz/commons.wikimedia.org
动物细胞的DNA被层层叠叠的膜结构保护着。图片来源:Mariana Ruiz/commons.wikimedia.org
因此数十年来,科学家一刻也没有停止过寻找更高效的基因编辑工具。
派往基因的“特务”
经过仔细研究,科学家发现,那保护DNA的堡垒里安保人员虽多,但好在智商捉急。比如当基因受到损伤的时候,负责具体修复工作的蛋白质只是在细胞里拉一段DNA过来跟损伤的DNA比对一下,如果两者长得差不多,拉来的那段就被当做模板拿去修复了。
上世纪八十年代,奥利弗·史密斯(Oliver Smithies)等科学家就想了一招:故意塞给细胞一堆“假模板”。他们首先根据需要人工合成一些DNA,并且故意把这些DNA序列设计得和某个基因的序列有点像,然后将它们塞到细胞里面去。细胞果然没让人失望,真的就拿“假模板”张冠李戴地修复了真的基因,结果把基因“修复”成了科学家所希望的样子。

奥利弗·史密斯(Oliver Smithies),遗传工程的奠基人之一,他也因此分享了2007年的诺贝尔生理或医学奖。图片来源:Chemical Heritage Foundation/commons.wikimedia.org
这种被称为“同源重组”的技术差不多就是最原始的“基因编辑”。只不过,这种“基因编辑”的前提是目标基因要自己出现损伤并启动细胞的修复机制。然而,DNA本就被重重保护,难得出现一丢丢损伤,你还要这损伤刚好出现在某个基因上,这种事可遇不可求呀。
不过,科学家的服务向来贴(xie)心(e):你细胞的DNA不容易受损伤,我就帮你受伤嘛——送个“特务”去细胞里搞破坏就是了。可难的是得让这特务只破坏科学家希望他破坏的基因,而不伤无辜吃瓜基因分毫。这样高素质的特务,当时科学家费了老鼻子劲在自然界中找了二十几年也没找出来。
到了21世纪初,他们心一横想,既然世上没有,那干脆人工造好了。于是,两个“人造特务”出现了:一个是Sangamo公司主导研发的“锌指核酸酶”(Zinc-finger nucleases,ZFNs),令一个则是由全球众多科学家一点一点捣鼓出来的“转录激活因子样效应物核酸酶”(transcription activator-like (TAL) effector nucleases,TALENs)。

ZFN(a)和TALEN(b)与目标DNA结合示意图。图片来源:Doi: 10.1016/j.tibtech.2013.04.004
ZFNs和TALENs都由两个部分融合组成,其中一部分认基因特别准但是不懂破坏,另一部分破坏力超群但是脸盲。人们本希望这样的组合可以各取所长,成为出色的人造特务。但实际用起来,ZFN太傻不好使唤,TALENs既不够狠又不够准。虽然能凑活用,但常常令科学家吐血三升。
不行,还得换。
2003年,西班牙微生物学家弗朗西斯科·莫伊卡(Francisco Mojica)给《自然》杂志投了个论文,惨遭拒稿。后来这篇论文又相继投递给了《美国科学院院刊》《分子微生物学》以及《核酸研究》等一系列期刊,但也都遭到了冷落。

弗朗西斯科·莫伊卡(Francisco Mojica),CRISPR系统第一个发现者。图片来源:Roberto Ruiz/University of Alicante Image Workshop
原因无它,因为这个研究的结论实在是太奇怪了。
莫伊卡在论文中指出,细菌和古菌当中广泛存在一种免疫机制,可以记住之前感染过它们的病毒的基因特征,从而展开针对性的防御,大有“同一个招式不能对圣斗士用两次”的意思。在当时人们的观念中,这些单细胞的细菌、古菌何德何能有这种厉害的免疫系统?
直到2005年,莫伊卡的研究成果才被个比较一般的学术期刊《分子演化杂志》所接收。从此以后,一个新的术语开始进入了人们的视野——“规律成簇间隔短回文重复”(Clustered regularly interspaced short palindromic repeats),简称 CRISPR(读作“克瑞斯破儿”)。[注1]
在随后五六年里,CRISPR犹如一个吸引无数玩家参与的拼图游戏,一块又一块的拼图碎片被世界各地的玩家拼接到位。终于在2011年,属于CRISPR的最后一块关键碎片被埃玛纽埃尔·卡彭蒂耶(Emmanulle Charpentier)拼了上去。她的论文昭示了CRISPR作为基因编辑工具的实力——科学家们苦苦寻觅的那位“天然特务”,或许近在眼前了。

埃玛纽埃尔·卡彭蒂耶(Emmanulle Charpentier),欧洲著名CRISPR专家,现代基因编辑技术的创始人之一。图片来源:Bianca Fioretti, Hallbauer & Fioretti/commons.wikimedia.org
技惊四座的CRISPR
当时,全世界研究基因编辑(那阵子还叫遗传工程)的专家正被用起来如砂石咯牙般的ZFNs和TALENs弄得苦不堪言,卡彭蒂耶的研究自然逃不过他们虎视眈眈的眼睛。不久之后,卡彭蒂耶就在美国微生物学学会上,遇到了那个后来为她带来无数荣誉与争议的人——詹妮弗·杜德娜(Jennifer Doudna)。

詹妮弗·杜德娜(Jennifer Doudna),美国著名结构生物学家与基因编辑技术专家,与卡彭蒂耶共同开创了第一代CRISPR/Cas9技术。图片来源:Mrl611/commons.wikimedia.org
杜德娜是加州大学伯克利分校的结构生物学教授,在此之前主要研究跟RNA有关的生物大分子结构。说起来,基因编辑只能算是她的“副业”,但是副业并不意味着业余。杜德娜与卡彭蒂耶合作不到一年时间,就发表了一篇在基因编辑史上里程碑性质的论文。
在论文中,她们先是证明了一种拥有SpCas9蛋白的CRISPR系统(注:自然界不同细菌和古菌的CRISPR系统都有所不同)最适合作为基因编辑的工具,因此后来这套基因编辑工具又被称为CRISPR/Cas9技术。之后,她们又用这套系统成功编辑了大肠杆菌的基因,结果表明CRISPR/Cas9比起之前的ZFN和TALENs高到不知道哪里去。CRISPR进军基因编辑领域的第一枪,就此漂亮打响。
而当杜德娜和卡彭蒂耶还在波多黎各谈笑风生时,一位来自麻省理工学院的科学家也敏锐地意识到了CRISPR的光辉前景,他的名字,叫做张锋。

张锋,CRISPR/Cas9技术创始人之一,世界最一流的CRISPR/Cas9专家,基因编辑技术的集大成者。图片来源:news.mit.edu
张锋不是一般人。在哈佛读本科期间,他师从于国际著名显微成像大牛,差一点拿诺贝尔奖的庄小威。读博时,他的导师是国际著名神经学技术大牛,长期挣扎着想拿诺贝尔奖的卡尔·戴塞尔罗斯。博士后时期,他工作在国际著名分子生物学大牛,准诺贝尔奖级研究者乔治·邱奇的实验室。在麻省理工学院工作阶段,他隔壁的实验室则属于一生多次与诺贝尔奖擦肩而过的鲁道夫·耶内施。
从高中开始,张锋已经接触基因编辑领域。当杜德娜与卡彭蒂耶率先发表出她们的学术成果时,其他人可能因为痛失先机而发出一声哀嚎,而张锋却一眼就看出了她们成果里那个小小瑕疵。
的确,CRISPR/Cas9是个好特工,但是杜德娜她们还没有把这个特工训练完全。对于细菌之类结构简单,DNA缺乏保护的细胞,当时的特工或许可以胜任,但包括我们人类在内的各种动物的细胞有着层层膜结构,DNA可谓身居堡垒之中,而杜德娜她们开发的CRISPR/Cas9根本就无法“潜入”堡垒深处,连DNA的面都别想见着,根本是有力使不出来。
张锋对CRISPR/Cas9做了几处微小而巧妙的修饰,一举解决了这个问题。在杜德娜的论文发表后半年左右,张锋成了第一个用CRISPR/Cas9编辑哺乳动物细胞基因组的科学家。[注2]
可这下事情就比较微妙了,如果说杜德娜和卡彭蒂耶发现了一座金矿,那么张锋就相当于是最先找到了这个金矿中的金子。如果按照学术界谁先发现就归谁的惯例,CRISPR/Cas9的发现,就成了一笔糊涂账。
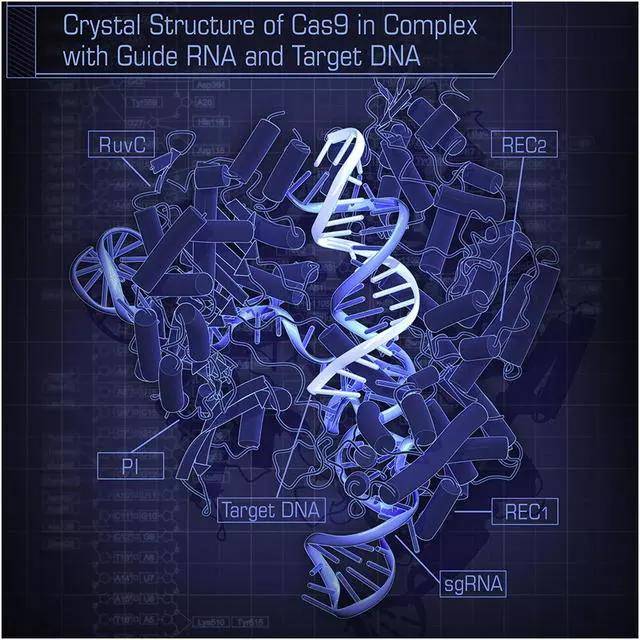
Cas9与引导RNA和目标DNA结合时的晶体结构示意图。图片来源:doi.org/10.1016/j.cell.2014.02.001
名与利之歌:专利的游戏
化敌为友总是首选。一开始,张锋及其盟友希望能拉拢杜德娜等人,他们合伙开了家名叫Editas Medicine的公司,想着到时候专利共享,岂不美哉。可惜没过多久,杜德娜等人就和张锋等谈判破裂,单飞出去办了一家名为Intellia Therapeutics的公司。两个阵营关于CRISPR/Cas9的专利之争,摆上了台面。
按理说,杜德娜和卡彭蒂耶发表论文在先,申请专利也比张锋他们早得多,优势很大。但这愣是被张锋团队一套组合拳给破功了。首先,张锋团队借助一系列司法解释把CRISPR的专利拆成了好几十份,从法理上把“金子”和“金矿”的所有权分了开来,然后又花钱走了专利审核的“快速通道”,让他们的专利比杜德娜的更早获得通过。最后,他们还巧妙运用了美国时任总统奥巴马的一些新政策,提出这个专利的有效性要基于“谁先完成研究”而非“谁先申请专利”,为此张锋瞬间掏出了过去两年的详细实验记录,明明白白地记录着他早在杜德娜的论文发表之前就已经走在了她的研究进度之前(同学们,知道记实验记录的重要性了吧!)。过了整整九个月,杜德娜团队才整理出自己的实验记录来加以反驳。
2016年初,张锋的上司,博德研究所所长埃里克·兰德尔写了一篇争议巨大的综述《CRISPR英雄谱》,把张锋拔高到了无以复加的位置,而杜德娜则被归进了为CRISPR基因编辑技术奠定基础的芸芸众生之中。那边厢,张锋果断宣布对学术界开放CRISPR/Cas9基因编辑的专利,只要研究不是出于商业目的,就可以随意免费地使用。不仅如此,他还把自己的研究资源(主要是质粒)放到公共库中,免费分发于天下。这一举赢得了整个学术界的支持。
更重要的是,张锋团队很快就把CRISPR/Cas9玩出了花——自2013年至今,张锋发的论文之多足可用排山倒海来形容,随便哪一篇开拓这一片科研新天地。自CRISPR/Cas9发明以来,其一半重大突破都出自张锋之手,剩下的也多少用到了张锋免费分发的科研资源,几年下来,张锋在基因编辑领域一哥的地位几近无可撼动。2014年,美国专利商标局(USPTO)批准了张锋所在的博德研究所的专利请求,来自加州大学的上诉也在2016年被悉数驳回。
不过杜德娜的团队也不是吃素的。虽然博德研究所看似在美国全胜,可到了欧洲和中国等地,专利认证就站到了杜德娜一边。除此以外,杜德娜和卡彭蒂耶还频频在各种高级学术奖项和学术峰会亮相,比如在2015年她俩就获得了有豪华版诺奖之称的“生命科学突破奖”。所以目前就世界范围而言,两拨人马可谓势均力敌。
 杜德娜与卡彭蒂耶共同荣获2015年生命科学突破奖。图片来源:independent.co.uk
杜德娜与卡彭蒂耶共同荣获2015年生命科学突破奖。图片来源:independent.co.uk
神仙打架,技术得力
科学家们争来争去,其实也是因为CRISPR/Cas9造福于人的无限潜力。
作为定点破坏基因方面最强大也最便宜的“特务”,CRISPR/Cas9大大降低了修改基因,尤其是动物基因的成本与技术门槛。张锋等人掀起的那一股编辑动物基因的风潮,正前所未有地席卷全球各地的实验室。
现在,任何科学家想要研究一个动物基因,只需大手一挥:“给我把这个基因敲了!”“给我把那段DNA序列塞到这个基因里!”不消半年,就能“定制”一批基因修饰动物出来做研究。当年砸大钱问公司买动物模型的历史,已经一去不复返。

中科院的科学家利用CRISPR/Cas9技术制作的基因敲除猴。在CRISPR/Cas9技术发明以前,制作基因敲除的灵长类几乎是不可想象的事情。图片来源:doi:10.1038/cr.2017.81
将CRISPR/Cas9用在医疗上的尝试也已不鲜见。2014年,美国贝勒医学院教授张普民和他的研究团队通过CRISPR/Cas9制造出了能够产生人类白蛋白的特种猪。2016年初,来自三个机构包括张锋在内的多个研究组试图利用CRISPR/Cas9系统来治疗动物的一种名为“杜兴氏肌肉萎缩症”的遗传病,结果真的大大提高了它们的预期寿命和生活质量。而近期,乔治·邱奇的得意门生,张锋的师妹杨璐菡所带领的团队也备受关注:他们试图通过大规模基因编辑,让猪产生适合移植给人类的器官。
这些案例都不过是冰山一角。随着对CRISPR/Cas系统的理解越发深入,人们已经可以利用它执行更多类型的基因编辑任务。如果从前它只是一个基因剪贴板,那现在几乎能称得上是基因编辑界的瑞士军刀了。CRISPR/Cas引爆了全方位的技术突破,毋庸置疑将生命科学带来进了新纪元。
CRISPR会造出弗兰肯斯坦的怪物吗?
不过,CRISPR/Cas9再强大也终究是一种工具,而人类现在在遗传学上毕竟道行尚浅,在某种意义上限制了工具的威能。就拿杨璐菡团队的工作来说,为了让猪长出可能适合移植到人类的器官,他们必须先清洗掉猪基因组当中的“内源性逆转录病毒”。
内源性逆转录病毒差不多就相当于已经被宿主“招安”了的病毒,两者不再互相伤害,甚至有些时候病毒还能给宿主帮上点忙。可要是猪的器官被移植到了人身上,猪的内源性病毒就又有了潜在风险。为了规避这些风险,杨璐菡专门把CRISPR/Cas9系统设计成“内源性病毒专杀工具”,将其注入猪的细胞中一次性消灭其中所有潜藏的内源性病毒。同时处理62个位点,那是CRISPR做过目标最多的单次编辑任务。
这第一步很成功。不过既然要的是猪器官,那只有细胞可不够——她得把这些猪细胞克隆成真猪。做这第二步,杨璐菡的团队用了两年时间,投入了庞大的财力人力才把他们所需要的猪给成功克隆出来。为啥这么难,至今也没人说得清楚。而如果真的要让猪为人类提供器官,那么除了这种内源性病毒以外需要改动的基因少说还有上百个,其中每一个都潜藏着无法预料的困难。CRISPR在基因组编辑层面的工作做得再出色,也需要在后续环节有成熟的技术跟进。
这也是为什么大家并不需要担心,科学家会由于对基因理解有限而不小心造个弗兰肯斯坦的怪物出来。要做任何事,一件工具永远是不够的,我们需要的是一个“工具箱”,然而很多事情能不能做成,往往取决于工具箱里最差的工具。
另一个限制则来自科学共同体的审慎。它来自人们对于基因编辑伦理问题的争论。这场争论最核心的观点,就是人类胚胎(以及生殖细胞)的基因是否可以编辑——毕竟这种对基因的改变是会一代一代遗传下去的。在现阶段,涉及基因组编辑的人类胚胎都在伦理委员会的监管下,确保不能发育成活人出生。
(注:本文写作于2017年12月。2018年11月,据人民网报道,南方科技大学生物系副教授贺建奎宣布,一对名为露露和娜娜的基因编辑婴儿于11月在中国健康诞生。)
基因编辑的故事,到这里也就暂时告一段落。对于这个生命科学领域最尖端的科技,人们憧憬着,可能也惶恐着。而技术终究有自己的发展规律,不为尧存,不为桀亡。CRISPR和它的后继者们究竟能给基因编辑的故事续上怎样的下一章?技术的研发者之间又能擦出怎样令人喜闻乐见的火花?我们不妨擦亮双眼等着看。
注释:
- 注1:CRISPR这个名词并非莫伊卡提出,不过在此之前人们并不知道这些东西有何意义,所以起了个就事论事描述性的名字。
- 注2:确切地说,这个“第一”需要和乔治·邱奇共享,因为他俩同时发表了这方面的论文,不过一般认为乔治·邱奇该论文的政治意义大于学术意义,所以在此暂不赘述。
参考文献
[1] Lander, Eric S. The Heroes of CRISPR. Cell. 2016. Volume 164 , Issue 1 , 18 – 28
[2] Capecchi, M.R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat. Rev. Genet. 2005; 6: 507–512
[3] Charpentier, Emmanuelle, and Jennifer A. Doudna. Biotechnology: Rewriting a genome. Nature. 2013. 495.7439 50-51
[4] Lander, Eric S. "The heroes of CRISPR." Cell 164.1 (2016): 18-28.
[5] Luhan Yang. et al. Genome-wide inactivation of porcine endogenous retroviruses (PERVs). Science. 2015. DOI: 10.1126/science.aad1191
[6] Niu D. et al. Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science. 2017. Sep 22;357(6357):1303-1307. doi: 10.1126/science.aan4187.
[7] Nelson et al. In vivo genome editing improves muscle function in a mouse model of Duchenne muscular dystrophy. Science DOI: 10.1126/science.aad5143
[8] Long et al. Postnatal genome editing partially restores dystrophin expression in a mouse model of muscular dystrophy. Science DOI: 10.1126/science.aad5725
[9] Tabebordbar et al. In vivo gene editing in dystrophic mouse muscle and muscle stem cells. Science DOI: 10.1126/science.aad5177
作者:鬼谷藏龙

